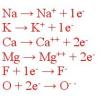
A parte i gas nobili, tutti gli altri atomi per avere minore energia ed essere più stabili tendono a raggiungere la configurazione elettronica esterna dell’ottetto oppure quella dell’Elio. Gli elementi di uno stesso gruppo hanno la stessa configurazione elettronica esterna. Ad esempio Berillio, Magnesio, Calcio, Stronzio, Bario e Radio hanno tutti due elettroni nel “guscio” elettronico esterno e i loro atomi hanno tutti una bassa energia di ionizzazione, cioè una scarsa forza di attrazione elettrostatica tra nucleo (carico positivamente per la presenza dei protoni) e elettroni esterni (dotati di carica negativa). L’energia di prima ionizzazione di un elemento è quell’energia necessaria per sottrarre ad un atomo l’elettrone più esterno. Questa energia diminuisce quando ci si sposta lungo un gruppo dall’alto in basso e aumenta quando ci spostiamo lungo un periodo, da sinistra a destra.
Se un atomo nell’orbitale esterno ha 1, 2 o 3 elettroni, per raggiungere la stabilità tenderà a perderli (purché ci sia qualche altro atomo che abbia la possibilità di riceverli!). Invece gli atomi che negli orbitali esterni hanno 5, 6 oppure 7 elettroni, tenderanno ad acquistarne rispettivamente 3, 2 o 1. Nella pratica, la tendenza a perdere o acquistare elettroni si manifesta in due modi: mediante la formazione di ioni oppure con la formazione di legami chimici. Consideriamo il Calcio la cui struttura elettronica è: [Ar]2; cedendo i due elettroni dell’ultimo orbitale la sua configurazione elettronica diventa la stessa dell’Argon [Ar] perciò raggiunge uno stato di bassa reattività. Analogamente faranno tutti gli elementi del II gruppo. Gli atomi degli elementi del I gruppo, avendo un solo elettrone esterno, lo cederanno con una facilità ancora maggiore per raggiungere l’ottetto.
Ogni atomo, avendo lo stesso numero di protoni (positivi) e di elettroni (negativi) è elettricamente neutro. Perciò nel momento in cui cede uno o più elettroni, nel nucleo ci saranno una o più cariche positive che non saranno bilanciate dalle cariche negative degli elettroni e l’atomo si trasforma in uno ione. Più precisamente, perdendo elettroni rimangono cariche positive in eccesso perciò si trasforma in uno ione positivo: un catione. Ad esempio:
Na → Na+ + 1e– (Na+ è un catione monovalente)
K → K+ + 1e–
Ca → Ca++ + 2e– (Ca++, oppure Ca2+, è un catione bivalente)
Mg → Mg++ + 2e–
Gli elementi del I gruppo tendono a dare cationi con una sola carica elettrica (monovalenti), quelli del II gruppo tendono a dare cationi bivalenti e quelli del III gruppo cationi trivalenti. I metalli di transizione invece danno cationi di cui non è facile prevedere la carica. Ad esempio il Ferro può formare cationi bivalenti (Fe++) o trivalenti (Fe+++), lo Stagno può formarli bivalenti (Sn++) o tetravalenti (Sn4+).
Gli elementi dei gruppi V, VI e VII invece tendono ad acquistare elettroni e a trasformarsi in ioni negativi: anioni. Consideriamo alcuni esempi.
F + 1e– → F– (anione monovalente)
O + 2e– → O– – (anione bivalente)
P + 3e– → P– – – oppure P3 – (anione trivalente)
La trasformazione di un atomo in uno ione (catione o anione) ha alcune conseguenze importanti, in particolare determina:
- una notevole riduzione dell’energia e perciò della reattività, per il raggiungimento della configurazione esterna dell’ottetto;
- una importante variazione del volume: quando da un atomo si forma un catione, il raggio e il volume atomico diminuiscono, quando si forma un anione il raggio e il volume atomico aumentano;
- la trasformazione di una specie chimica elettricamente neutra in un’altra dotata di cariche elettriche positive (cationi) o negative (anioni).
