Nelle reazioni chimiche, in particolare nelle reazioni a catena, cioè reazioni nelle quali due o più stadi si ripetono ciclicamente, spesso all’inizio è necessario un intervento esterno, un fattore che inneschi la reazione. I fattori che innescano le reazioni possono essere di diverso tipo: l’azione della luce o di altre radiazioni elettromagnetiche come i raggi UV, urti con molecole particolarmente reattive, l’azione della pressione elevata, l’azione del calore, soprattutto di temperature elevate. RAI Scuola: Radicali liberi.
Il compito di questi fattori esterni è quello di determinare la formazione di specie chimiche (atomi liberi e radicali liberi) altamente reattivi.
Gli atomi liberi contengono uno o più elettroni spaiati sugli orbitali esterni, ad esempio la molecola biatomica di bromo (Br2) per effetto dell’azione della luce o a causa di urti violenti con altre molecole, si scinde in due atomi liberi di bromo: Br2 → 2Br . , il puntino in alto a destra del simboli dei due atomi ricorda che in ciascun atomo di bromo è presente un elettrone spaiato. La struttura di Lewis dell’atomo di bromo evidenzia che l’atomo è contornato da sette elettroni, sei appaiati in tre coppie e uno spaiato che rende l’atomo di bromo fortemente reattivo. Lo stesso si può dire degli altri elementi del gruppo 17: fluoro, cloro, iodio e astato.
I radicali liberi sono invece raggruppamenti di atomi contenenti uno o più elettroni spaiati. Sono radicali liberi, ad esempio, il metile .CH3, l’etile .CH2CH3, il propile .CH2CH2CH3, che derivano rispettivamente dal metano, dall’etano e dal propano (tutti alcani) per effetto dell’azione di fattori esterni.
Altro esempio: l’alogenazione degli alcani avviene con una reazione a catena che inizia con la formazione di atomi liberi (ad esempio di cloro Cl. ) a causa di temperature elevate o raggi ultravioletti. Poi prosegue quando gli atomi liberi di cloro colpiscono le molecole dell’alcano (ad esempio l’etano C2H6) che diventa un radicale libero (.CH2CH3) e la reazione procede e si propaga fino alla sua chiusura, che può avvenire perché si riducono gli urti, si abbassa la temperatura o per altre cause.
Sono radicali liberi anche tutti gli atomi singoli che formano le molecole biatomiche di elementi; H2, O2, N2, F2, Cl2, Br2, I2. Perciò in natura non sono presenti stabilmente come atomi singoli ma come molecole biatomiche.
Da alcuni decenni c’è un interesse particolare per i radicali liberi e i prodotti reattivi dell’ossigeno che vengono formati in piccola percentuale ma continuamente durante il metabolismo cellulare, in particolare durante la respirazione cellulare che avviene nei mitocondri di tutte le cellule aerobie in cui si ha: C6H12O6 + 6O2 → 6CO2 + 6H2O + energia. I motivi di quest’interesse riguardano il ruolo di queste sostanze nell’invecchiamento cellulare, la longevità delle persone e il mantenimento di un buono stato di salute. I danni causati dall’ossigeno riguardano i prodotti secondari che si formano nell’insieme di processi metabolici che rendono possibile la vita.
L’ossigeno perciò, oltre ad essere fondamentale per la vita di tutti gli organismi aerobi, ha una sua tossicità che riguarda i suoi radicali liberi e gli altri prodotti reattivi.

L’atomo di ossigeno infatti per raggiungere la stabilità, quindi la configurazione elettronica esterna dell’ottetto, ha bisogno di ricevere o condividere due elettroni con altri atomi. Se invece all’atomo di ossigeno si trasferisce un solo elettrone, si producono:
– l’anione superossido O2– formato dall’aggiunta di un elettrone all’ossigeno molecolare biatomico;
– il perossido di idrogeno H2O2 o acqua ossigenata;
– il radicale ossidrile o idrossilico –OH;
– l’ossigeno singoletto, che non è un radicale libero perché non possiede elettroni spaiati: 1O2.
La produzione di queste sostanze nel corpo umano, ma anche negli altri viventi, è fisiologica, però può essere accelerata da vari fattori: sostanze inquinanti, fumo, farmaci, sostanze stupefacenti, additivi chimici messi negli alimenti e nelle bevande, raggi UV e radiazioni ionizzanti. Agorà Scienze Biomediche:

 Alcuni gruppi di ricerca, tra i tanti problemi ambientali, hanno focalizzato la loro attenzione sulla perdita di ossigeno disciolto nelle acque marine (deossigenazione degli oceani). In particolare, alla COP 25 che si è tenuta lo scorso dicembre a Madrid, la IUNC (Unione Internazionale per la Conservazione della Natura) ha presentato un ampio rapporto sull’argomento:
Alcuni gruppi di ricerca, tra i tanti problemi ambientali, hanno focalizzato la loro attenzione sulla perdita di ossigeno disciolto nelle acque marine (deossigenazione degli oceani). In particolare, alla COP 25 che si è tenuta lo scorso dicembre a Madrid, la IUNC (Unione Internazionale per la Conservazione della Natura) ha presentato un ampio rapporto sull’argomento:  D’altra parte è ben noto che la solubilità dei gas (al contrario dei solidi) in acqua diminuisce
D’altra parte è ben noto che la solubilità dei gas (al contrario dei solidi) in acqua diminuisce

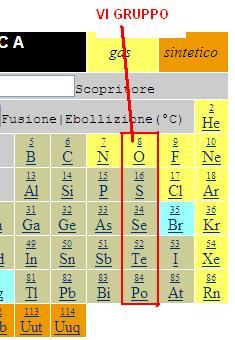 Siamo nel gruppo dell’ossigeno. Possiamo chiamarlo così perché questo elemento è quello più importante del VI gruppo ed è fondamentale nella composizione dei viventi, della litosfera, dell’idrosfera e dell’atmosfera del nostro pianeta. Forma il 25% della massa del nostro corpo, sia perché è un componente dell’acqua sia perché entra nella composizione di tutte le biomolecole: carboidrati, lipidi, proteine e acidi nucleici. Si tratta anche di un elemento essenziale nei due processi chimici più importanti del nostro pianeta: la respirazione cellulare e la fotosintesi. La prima consiste in un insieme di reazioni che avvengono in tutte le cellule animali e vegetali e che decompongono il glucosio in CO2 e acqua consumando ossigeno e liberando energia sotto forma di molecole di ATP e calore. La seconda invece riguarda un complesso di reazioni che, avvenendo in piante, alghe, alcuni protisti e batteri, convertono l’energia luminosa in energia chimica contenuta nei legami degli atomi delle molecole di glucosio e liberano ossigeno molecolare. Oltre all’ossigeno, fanno parte del VI gruppo anche zolfo, selenio, tellurio e polonio. Si tratta di non metalli. Con l’idrogeno formano composti di formula generale XH2.
Siamo nel gruppo dell’ossigeno. Possiamo chiamarlo così perché questo elemento è quello più importante del VI gruppo ed è fondamentale nella composizione dei viventi, della litosfera, dell’idrosfera e dell’atmosfera del nostro pianeta. Forma il 25% della massa del nostro corpo, sia perché è un componente dell’acqua sia perché entra nella composizione di tutte le biomolecole: carboidrati, lipidi, proteine e acidi nucleici. Si tratta anche di un elemento essenziale nei due processi chimici più importanti del nostro pianeta: la respirazione cellulare e la fotosintesi. La prima consiste in un insieme di reazioni che avvengono in tutte le cellule animali e vegetali e che decompongono il glucosio in CO2 e acqua consumando ossigeno e liberando energia sotto forma di molecole di ATP e calore. La seconda invece riguarda un complesso di reazioni che, avvenendo in piante, alghe, alcuni protisti e batteri, convertono l’energia luminosa in energia chimica contenuta nei legami degli atomi delle molecole di glucosio e liberano ossigeno molecolare. Oltre all’ossigeno, fanno parte del VI gruppo anche zolfo, selenio, tellurio e polonio. Si tratta di non metalli. Con l’idrogeno formano composti di formula generale XH2.