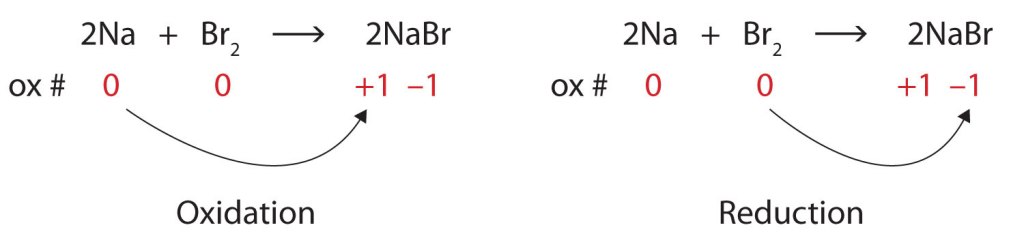
L’esercizio proposto: Considera le seguenti equazioni non bilanciate, alcune sono reazioni di ossidoriduzione e altre no. Bilanciale. Per ciascun caso indica se si tratta di una reazione redox e, in caso affermativo, quale elemento si è ridotto, quale si è ossidato, qual è l’agente ossidante e qual è quello riducente.
a) BaCl2 + Na2SO4 → NaCl + BaSO4
b) H2 + N2 → NH3
c) C + H2O → CO + H2
d) AgNO3 + FeCl3 → AgCl + (FeNO3)3
e) H2O2 + PbS → PbSO4 + H2O
f) HNO3 + H3PO3 → NO + H3PO4 + H2O
Confronta con le tue risposte.
a) bilanciata: BaCl2 + Na2SO4 → 2NaCl + BaSO4
Non è una reazione di ossidoriduzione, gli atomi nei prodotti non hanno cambiato il loro n.o. rispetto a quello dei reagenti.
b) bilanciata: 3H2 + N2 → 2NH3
Sì, è una reazione di ossidoriduzione. H si ossida quindi è l’agente riducente, N si riduce quindi è l’agente ossidante.
c) è già bilanciata: C + H2O → CO + H2
Sì, è una reazione di ossidoriduzione. C si ossida perciò è l’agente riducente, e N si riduce, è l’agente ossidante.
d) bilanciata: 3AgNO3 + FeCl3 → 3AgCl + (FeNO3)3
Non è una reazione di ossidoriduzione.
e) bilanciata: 4H2O2 + PbS → PbSO4 + 4H2O
Sì, è una reazione di ossidoriduzione. S si ossida perciò è l’agente riducente, e O si riduce, è l’agente ossidante.
f) bilanciata: 2HNO3 + 3H3PO3 → 2NO + 3H3PO4 + H2O
Sì, è una reazione di ossidoriduzione. P si ossida perciò è l’agente riducente, e N si riduce, è l’agente ossidante.
Alcune regole fondamentali da ricordare:
L’H ha sempre numero di ossidazione +1, tranne negli idruri dei metalli alcalini, ad es. NaH e negli idruri dei metalli alcalino-terrosi, ad es. CaH2. In questi casi il n.o. è -1.
L’O ha sempre n.o. -2, tranne nei perossidi, ad es. H2O2 , IN cui è -1 e nei superossidi, ad es. KO2 , in cui il n.o. è -1/2, oppure in F2O in cui è +2.
I metalli alcalini hanno sempre n.o. +1.
I metalli alcalino-terrosi hanno sempre n.o. +2.
Il F ha n.o. -1.
L’Al ha n.o. +3.
Lo Zn ha n.o. +2.