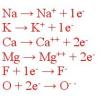In due precedenti post è stata descritta la formazione degli ioni in generale e gli ioni positivi (cationi) più comuni con i relativi nomi. In questo post vengono descritti gli ioni negativi (anioni).
In due precedenti post è stata descritta la formazione degli ioni in generale e gli ioni positivi (cationi) più comuni con i relativi nomi. In questo post vengono descritti gli ioni negativi (anioni).
Gli ioni negativi costituiti da un solo atomo (monoatomici) derivano dagli atomi degli elementi non metallici. Vengono denominati aggiungendo il suffisso -uro al nome dell’elemento, per cui abbiamo lo ione fluoruro (F– ), lo ione idruro (H– ), lo ione solfuro (S2- ), lo ione nitruro (N3- ), lo ione fosfuro (P3- ), lo ione cloruro (Cl– ) e così via. Tra questi ioni monoatomici però, lo ione ossido (O2- ) costituisce un’eccezione nella nomenclatura.
Gli ioni negativi poliatomici sono formati da più atomi e in genere si formano quando gli ossoacidi in acqua perdono ioni idrogeno (H+ ). Questi anioni prendono il nome dall’ossoacido da cui derivano, ad esempio lo ione nitrato (NO3– ) si può ottenere dall’acido nitrico (HNO3 acido triossonitrico, secondo la nomenclatura IUPAC) per perdita di uno ione idrogeno (H+ ): HNO3 (H2O)→ H+ + NO3– .
Gli anioni inoltre presentano una carica negativa per ogni idrogeno perduto: lo ione idrogeno solfato (HSO4– ) ha perso un solo ioni idrogeno (H+ ) rispetto all’acido tetraossosolforico (H2SO4 ); mentre lo ione idrogeno fosfato (HPO42- ) ha perso due ioni idrogeno (2H+ ) rispetto all’acido tetraossofosforico (H3PO4 ).
Nella nomenclatura tradizionale, se il non metallo presenta solo due tipi di ossoacidi, il nome dell’anione si ottiene cambiando il suffisso -oso in -ito e il suffisso -ico in -ato.
Bisogna ricordare che gli ioni H+ prodotti dall’acido che si trova in soluzione acquosa, colorano alcuni pigmenti, ad esempio il tornasole, che vengono detti “indicatori” e permettono di determinare con buona approssimazione il grado di acidità della soluzione. Per una determinazione più precisa è necessario uno strumento: il piaccametro. Crediti immagine anioni_tav_periodica: Unica.it. 



 L’elettrolisi è una reazione chimica di decomposizione che interessa sostanze a carattere ionico: acidi, basi e sali, in grado di dissociarsi in ioni negativi e ioni positivi. La reazione di decomposizione dell’elettrolisi è operata dalla corrente elettrica ed ha come conseguenza la trasformazione di energia elettrica in energia chimica.
L’elettrolisi è una reazione chimica di decomposizione che interessa sostanze a carattere ionico: acidi, basi e sali, in grado di dissociarsi in ioni negativi e ioni positivi. La reazione di decomposizione dell’elettrolisi è operata dalla corrente elettrica ed ha come conseguenza la trasformazione di energia elettrica in energia chimica.  Nelle trasformazioni chimiche uno o più elettroni dell’ultimo “guscio” vengono condivisi oppure si spostano da una specie chimica all’altra. Lo spostamento avviene nelle reazioni di ossidoriduzione, in cui la specie (atomo, ione, ione poliatomico) che acquista elettroni si riduce, quella che li cede si ossida.
Nelle trasformazioni chimiche uno o più elettroni dell’ultimo “guscio” vengono condivisi oppure si spostano da una specie chimica all’altra. Lo spostamento avviene nelle reazioni di ossidoriduzione, in cui la specie (atomo, ione, ione poliatomico) che acquista elettroni si riduce, quella che li cede si ossida. In base a queste semplici regole, conoscendo la formula di un composto e consultando i possibili numeri di ossidazione degli elementi dalla Tavola periodica (non si chiede di impararli a memoria), si può determinare il n. o. di ogni elemento di quel composto.
In base a queste semplici regole, conoscendo la formula di un composto e consultando i possibili numeri di ossidazione degli elementi dalla Tavola periodica (non si chiede di impararli a memoria), si può determinare il n. o. di ogni elemento di quel composto.